प्रतिचुम्बकत्व: Difference between revisions
Listen
Robin singh (talk | contribs) mNo edit summary |
No edit summary |
||
| (13 intermediate revisions by 2 users not shown) | |||
| Line 2: | Line 2: | ||
[[Category:रसायन विज्ञान]] | [[Category:रसायन विज्ञान]] | ||
[[Category:कक्षा-12]] | [[Category:कक्षा-12]] | ||
''' | [[Category:Vidyalaya Completed]] | ||
डी ब्लॉक तत्व [[आयन]] चुंबकीय गुण दर्शाते हैं। जिन तत्वों के इलेक्ट्रॉनिक विन्यास में सबसे बाहरी संयोजी उपकोश में सभी इलेक्ट्रॉन युग्मित होते हैं, उन्हें '''प्रतिचुंबकीय [[पदार्थ]]''' कहा जाता है। और वह गुण जिसके द्वारा वे इस प्रतिचुंबकीय व्यवहार को दर्शाते हैं, उसे तत्वों या आयनों के प्रतिचुंबकत्व के रूप में जाना जाता है। चूंकि इन प्रतिचुंबकीय तत्वों या आयनों में कोई अयुग्मित इलेक्ट्रॉन नहीं होता है, इसलिए उनके अणुओं में कोई शुद्ध चुंबकीय आघूर्ण नहीं होता है दूसरे शब्दों में कहें तो इनका चुंबकीय आघूर्ण शून्य होता है। | |||
क्योंकि इन प्रतिचुंबकीय [[यौगिक]] में उनके संयोजी शेल में युग्मित इलेक्ट्रॉन होते हैं, इसलिए ऑर्बिटल्स में उपस्थित इलेक्ट्रॉन विपरीत स्पिन के होते हैं, इन यौगिकों को बाहरी चुंबकीय क्षेत्र में रखने पर, यह चुंबकीय क्षेत्र का विरोध करता है। इसका मतलब है कि वे चुंबकीय क्षेत्र में प्रतिकर्षित होते हैं | |||
== प्रतिचुंबकीय पदार्थों का निर्धारण == | |||
अब हम देखेंगे कि यह कैसे निर्धारित किया जाता है कि कोई तत्व या आयन प्रतिचुंबकीय है या नहीं। | |||
'''उदाहरण के लिए:''' हम Co<sup>2+</sup>, Fe<sup>2+</sup>, Sc<sup>3+</sup>,Cu<sup>+</sup>, Ag<sup>+</sup> आयनों का एक सेट लेते हैं। सभी का आफबाऊ इलेक्ट्रॉनिक विन्यास लिखिए , इसके बाद हुंड नियम के अनुसार इलेक्ट्रॉन को उपकोश की कक्षाओं में भरे। | |||
आयन का इलेक्ट्रॉनिक विन्यास लिखने के लिए, हमें पहले सामान्य तत्व का इलेक्ट्रॉनिक विन्यास लिखना होगा, | |||
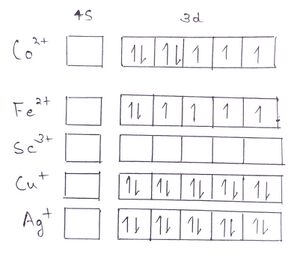
Co (27)= [Ar] 4s<sup>2</sup> 3d<sup>7</sup> | |||
उसके बाद हम देखेंगे कि इलेक्ट्रॉन पहले किस उपकोश से बाहर निकलेगा, जैसे Co<sup>2+</sup> में इलेक्ट्रॉन पहले 4s उपकोश से बाहर निकलता है, उसके बाद वह 3d उपकोश ऑर्बिटल्स से बाहर निकलता है। क्योंकि चौथा कोश तीसरे से अधिक दूर है। | |||
Co<sup>2+</sup> (25)= [Ar] 4s<sup>0</sup> 3d<sup>7</sup> | |||
[[File:Diamagnetism.jpg|thumb|डी ब्लॉक धातु आयनों का इलेक्ट्रॉनिक विन्यास]] | |||
इसी प्रकार यहां अन्य आयनों का इलेक्ट्रॉनिक विन्यास नीचे दिया गया है। [Ar] या [Kr] प्रारंभिक विन्यास को अक्रिय गैस विन्यास के समान इंगित करता है। | |||
= | '''Fe<sup>2+</sup> (24)= [Ar] 4s<sup>0</sup> 3d<sup>6</sup>''' | ||
'''Sc<sup>3+</sup> (18)= [Ar] 4s<sup>0</sup> 3d<sup>0</sup>''' | '''Sc<sup>3+</sup> (18)= [Ar] 4s<sup>0</sup> 3d<sup>0</sup>''' | ||
| Line 17: | Line 30: | ||
'''Ag+ (46)= [Kr] 5s<sup>0</sup> 4d<sup>10</sup>''' | '''Ag+ (46)= [Kr] 5s<sup>0</sup> 4d<sup>10</sup>''' | ||
Co<sup>2+</sup> आयन में s उपकोश में कोई भी इलेक्ट्रॉन नहीं है, लेकिन d उपकोश में 7 इलेक्ट्रॉन हैं जिसमें से तीन इलेक्ट्रॉन अयुग्मित हैं, अर्थात यह प्रतिचुंबकीय नहीं है। | |||
Fe<sup>2+</sup> आयन में s उपकोश में कोई भी इलेक्ट्रॉन नहीं है, लेकिन d उपकोश में 6 इलेक्ट्रॉन हैं जिसमें से 4 इलेक्ट्रॉन अयुग्मित हैं। अर्थात यह भी प्रतिचुंबकीय नहीं है। | |||
Sc<sup>3+</sup> में , इस आयन के बाहरी उपकोश में कोई भी इलेक्ट्रॉन नहीं है, अर्थात यह प्रतिचुंबकीय है। Cu<sup>+</sup> में , इस आयन के s उपकोश में कोई भी इलेक्ट्रॉन नहीं है, और d उपकोश में पूरे 10 इलेक्ट्रॉन हैं जो कि पूरी तरीके से युग्मित हैं, अर्थात यह भी प्रतिचुंबकीय है। Ag<sup>+</sup> में , s उपकोश में कोई भी इलेक्ट्रॉन नहीं है, और d उपकोश में पूरे 10 इलेक्ट्रॉन हैं यह भी पूरी तरीके से युग्मित हैं, अर्थात यह भी प्रतिचुंबकीय है। | |||
इसमें आप देख सकते हैं, अंतिम तीन आयन के इलेक्ट्रॉनिक विन्यास में सबसे बाहरी संयोजी उपकोश में सभी युग्मित इलेक्ट्रॉन हैं। इसलिए इन आयनों को प्रकृति में प्रतिचुंबकीय कहा जाता है। | |||
इससे हमने सीखा कि कोई भी तत्व या आयन प्रतिचुंबकीय है या नहीं, यह हम उसके इलेक्ट्रॉनिक विन्यास को देखकर बताते हैं। | इससे हमने सीखा कि कोई भी तत्व या आयन प्रतिचुंबकीय है या नहीं, यह हम उसके इलेक्ट्रॉनिक विन्यास को देखकर बताते हैं। | ||
== | == प्रतिचुंबकीय पदार्थों के गुण == | ||
* | * प्रतिचुंबकीय पदार्थों में बाहरी [[संयोजी कक्षा|संयोजी]] उपकोश में, हुंड के नियम के अनुसार सभी युग्मित [[इलेक्ट्रॉन]] होते हैं। | ||
* प्रतिचुंबकीय यौगिक सामान्यतः रंगहीन होते हैं, क्योंकि उनमें कोई मुक्त इलेक्ट्रॉन नहीं होता है इसलिए उनमें कोई मुक्त इलेक्ट्रॉन [[संक्रमण धातुएँ|संक्रमण]] नहीं संभव होता है | |||
* प्रतिचुंबकीय यौगिक | |||
* तापमान बढ़ने से किसी भी पदार्थ के प्रतिचुंबकीय गुण अप्रभावित रहते हैं। | * तापमान बढ़ने से किसी भी पदार्थ के प्रतिचुंबकीय गुण अप्रभावित रहते हैं। | ||
* सभी सुपरकंडक्टर | * सभी सुपरकंडक्टर सामान्यतः प्रतिचुंबकीय प्रकृति के होते हैं क्योंकि वे चुंबकीय क्षेत्र में विकर्षित होते हैं। | ||
* प्रति चुंबकीय पदार्थों में चुंबकीय आघूर्ण नहीं होता है। | * प्रति चुंबकीय पदार्थों में चुंबकीय आघूर्ण नहीं होता है। | ||
== | == प्रतिचुम्बकत्व से संबंधित कुछ महत्वपूर्ण प्रश्न == | ||
* प्रतिचुंबकीय पदार्थ क्या हैं कुछ उदाहरण देकर समझाइए। | * प्रतिचुंबकीय पदार्थ क्या हैं? कुछ उदाहरण देकर समझाइए। | ||
* प्रतिचुंबकीय पदार्थ बाह्य चुंबकीय क्षेत्र में विकर्षित क्यों होता है? | * प्रतिचुंबकीय पदार्थ बाह्य चुंबकीय क्षेत्र में विकर्षित क्यों होता है? | ||
* प्रतिचुंबकीय पदार्थ का चुंबकीय | * प्रतिचुंबकीय पदार्थ का चुंबकीय आघूर्ण शून्य क्यों होता है? | ||
* इन आयनों की जांच करें और बताएं कि ये प्रतिचुंबकीय हैं या नहीं। | |||
Fe<sup>3+</sup>, Ti<sup>2+</sup>, Mn<sup>5+</sup>, Co<sup>2+</sup> | |||
Latest revision as of 17:20, 30 May 2024
डी ब्लॉक तत्व आयन चुंबकीय गुण दर्शाते हैं। जिन तत्वों के इलेक्ट्रॉनिक विन्यास में सबसे बाहरी संयोजी उपकोश में सभी इलेक्ट्रॉन युग्मित होते हैं, उन्हें प्रतिचुंबकीय पदार्थ कहा जाता है। और वह गुण जिसके द्वारा वे इस प्रतिचुंबकीय व्यवहार को दर्शाते हैं, उसे तत्वों या आयनों के प्रतिचुंबकत्व के रूप में जाना जाता है। चूंकि इन प्रतिचुंबकीय तत्वों या आयनों में कोई अयुग्मित इलेक्ट्रॉन नहीं होता है, इसलिए उनके अणुओं में कोई शुद्ध चुंबकीय आघूर्ण नहीं होता है दूसरे शब्दों में कहें तो इनका चुंबकीय आघूर्ण शून्य होता है।
क्योंकि इन प्रतिचुंबकीय यौगिक में उनके संयोजी शेल में युग्मित इलेक्ट्रॉन होते हैं, इसलिए ऑर्बिटल्स में उपस्थित इलेक्ट्रॉन विपरीत स्पिन के होते हैं, इन यौगिकों को बाहरी चुंबकीय क्षेत्र में रखने पर, यह चुंबकीय क्षेत्र का विरोध करता है। इसका मतलब है कि वे चुंबकीय क्षेत्र में प्रतिकर्षित होते हैं
प्रतिचुंबकीय पदार्थों का निर्धारण
अब हम देखेंगे कि यह कैसे निर्धारित किया जाता है कि कोई तत्व या आयन प्रतिचुंबकीय है या नहीं।
उदाहरण के लिए: हम Co2+, Fe2+, Sc3+,Cu+, Ag+ आयनों का एक सेट लेते हैं। सभी का आफबाऊ इलेक्ट्रॉनिक विन्यास लिखिए , इसके बाद हुंड नियम के अनुसार इलेक्ट्रॉन को उपकोश की कक्षाओं में भरे।
आयन का इलेक्ट्रॉनिक विन्यास लिखने के लिए, हमें पहले सामान्य तत्व का इलेक्ट्रॉनिक विन्यास लिखना होगा,
Co (27)= [Ar] 4s2 3d7
उसके बाद हम देखेंगे कि इलेक्ट्रॉन पहले किस उपकोश से बाहर निकलेगा, जैसे Co2+ में इलेक्ट्रॉन पहले 4s उपकोश से बाहर निकलता है, उसके बाद वह 3d उपकोश ऑर्बिटल्स से बाहर निकलता है। क्योंकि चौथा कोश तीसरे से अधिक दूर है।
Co2+ (25)= [Ar] 4s0 3d7
इसी प्रकार यहां अन्य आयनों का इलेक्ट्रॉनिक विन्यास नीचे दिया गया है। [Ar] या [Kr] प्रारंभिक विन्यास को अक्रिय गैस विन्यास के समान इंगित करता है।
Fe2+ (24)= [Ar] 4s0 3d6
Sc3+ (18)= [Ar] 4s0 3d0
Cu+ (28)= [Ar] 4s0 3d10
Ag+ (46)= [Kr] 5s0 4d10
Co2+ आयन में s उपकोश में कोई भी इलेक्ट्रॉन नहीं है, लेकिन d उपकोश में 7 इलेक्ट्रॉन हैं जिसमें से तीन इलेक्ट्रॉन अयुग्मित हैं, अर्थात यह प्रतिचुंबकीय नहीं है।
Fe2+ आयन में s उपकोश में कोई भी इलेक्ट्रॉन नहीं है, लेकिन d उपकोश में 6 इलेक्ट्रॉन हैं जिसमें से 4 इलेक्ट्रॉन अयुग्मित हैं। अर्थात यह भी प्रतिचुंबकीय नहीं है।
Sc3+ में , इस आयन के बाहरी उपकोश में कोई भी इलेक्ट्रॉन नहीं है, अर्थात यह प्रतिचुंबकीय है। Cu+ में , इस आयन के s उपकोश में कोई भी इलेक्ट्रॉन नहीं है, और d उपकोश में पूरे 10 इलेक्ट्रॉन हैं जो कि पूरी तरीके से युग्मित हैं, अर्थात यह भी प्रतिचुंबकीय है। Ag+ में , s उपकोश में कोई भी इलेक्ट्रॉन नहीं है, और d उपकोश में पूरे 10 इलेक्ट्रॉन हैं यह भी पूरी तरीके से युग्मित हैं, अर्थात यह भी प्रतिचुंबकीय है।
इसमें आप देख सकते हैं, अंतिम तीन आयन के इलेक्ट्रॉनिक विन्यास में सबसे बाहरी संयोजी उपकोश में सभी युग्मित इलेक्ट्रॉन हैं। इसलिए इन आयनों को प्रकृति में प्रतिचुंबकीय कहा जाता है।
इससे हमने सीखा कि कोई भी तत्व या आयन प्रतिचुंबकीय है या नहीं, यह हम उसके इलेक्ट्रॉनिक विन्यास को देखकर बताते हैं।
प्रतिचुंबकीय पदार्थों के गुण
- प्रतिचुंबकीय पदार्थों में बाहरी संयोजी उपकोश में, हुंड के नियम के अनुसार सभी युग्मित इलेक्ट्रॉन होते हैं।
- प्रतिचुंबकीय यौगिक सामान्यतः रंगहीन होते हैं, क्योंकि उनमें कोई मुक्त इलेक्ट्रॉन नहीं होता है इसलिए उनमें कोई मुक्त इलेक्ट्रॉन संक्रमण नहीं संभव होता है
- तापमान बढ़ने से किसी भी पदार्थ के प्रतिचुंबकीय गुण अप्रभावित रहते हैं।
- सभी सुपरकंडक्टर सामान्यतः प्रतिचुंबकीय प्रकृति के होते हैं क्योंकि वे चुंबकीय क्षेत्र में विकर्षित होते हैं।
- प्रति चुंबकीय पदार्थों में चुंबकीय आघूर्ण नहीं होता है।
प्रतिचुम्बकत्व से संबंधित कुछ महत्वपूर्ण प्रश्न
- प्रतिचुंबकीय पदार्थ क्या हैं? कुछ उदाहरण देकर समझाइए।
- प्रतिचुंबकीय पदार्थ बाह्य चुंबकीय क्षेत्र में विकर्षित क्यों होता है?
- प्रतिचुंबकीय पदार्थ का चुंबकीय आघूर्ण शून्य क्यों होता है?
- इन आयनों की जांच करें और बताएं कि ये प्रतिचुंबकीय हैं या नहीं।
Fe3+, Ti2+, Mn5+, Co2+