बोर त्रिज्या: Difference between revisions
Listen
No edit summary |
(→आरेख) |
||
| (2 intermediate revisions by the same user not shown) | |||
| Line 16: | Line 16: | ||
ℏ घटा हुआ प्लैंक स्थिरांक (<math>1.0545718\times10^{-34}J\cdot s , </math>) है। | ℏ घटा हुआ प्लैंक स्थिरांक (<math>1.0545718\times10^{-34}J\cdot s , </math>) है। | ||
m | <math>m</math> इलेक्ट्रॉन का द्रव्यमान (<math>9.10938356\times10^{-31}kg,</math> ) है। | ||
e प्राथमिक आवेश (<math>1.60217662\times10{-19}\;C </math>) है। | <math>e</math> प्राथमिक आवेश (<math>1.60217662\times10{-19}\;C </math>) है। | ||
== भौतिक व्याख्या == | == भौतिक व्याख्या == | ||
| Line 24: | Line 24: | ||
== आरेख == | == आरेख == | ||
</syntaxhighlight>आरेख में, नाभिक (प्रोटॉन) केंद्र में है, और इलेक्ट्रॉन बोर त्रिज्या (<math>a_0</math>) की औसत दूरी पर नाभिक की परिक्रमा करता है। इलेक्ट्रॉन की गति को विशिष्ट ऊर्जा स्तरों में परिमाणित किया जाता है, जिसमें | यहां हाइड्रोजन परमाणु में बोर त्रिज्या की अवधारणा को दर्शाने वाला एक सरलीकृत चित्र दिया गया है: | ||
[[File:Bohr atom model.svg|thumb|हाइड्रोजन परमाणु <math>(Z = 1)</math>या हाइड्रोजन जैसा आयन <math>(Z > 1)</math>का बोर मॉडल, जहां एक परमाणु खोल तक सीमित नकारात्मक चार्ज इलेक्ट्रॉन एक छोटे, सकारात्मक चार्ज परमाणु नाभिक को घेरता है और जहां एक इलेक्ट्रॉन कक्षाओं के बीच प्लुति (कूदता) है, विद्युत चुम्बकीय ऊर्जा (<math>h\nu</math>) की उत्सर्जित या अवशोषित मात्रा के साथ होता है।जिन कक्षाओं में इलेक्ट्रॉन यात्रा कर सकता है उन्हें धूसर वक्र ( ग्रे सर्कल ) के रूप में दिखाया गया है; उनकी त्रिज्या (बोर त्रिज्या <math>a_0</math>) <math>n^{2},</math> के रूप में बढ़ती है, जहां <math>n </math> प्रमुख क्वांटम संख्या है। यहां दर्शाया गया <math>3 \longrightarrow 2 </math>संक्रमण बामर श्रृंखला की पहली पंक्ति उत्पन्न करता है, और हाइड्रोजन <math>(Z = 1)</math> के लिए इसका परिणाम तरंग दैर्ध्य <math>656 nm</math> (लाल प्रकाश) का एक फोटॉन होता है।]] | |||
<syntaxhighlight lang="scss"> | |||
</syntaxhighlight>आरेख में, नाभिक (प्रोटॉन) केंद्र में है, और इलेक्ट्रॉन बोर त्रिज्या (<math>a_0</math>) की औसत दूरी पर नाभिक की परिक्रमा करता है। इलेक्ट्रॉन की गति को विशिष्ट ऊर्जा स्तरों में परिमाणित किया जाता है, जिसमें आधार अवस्था में निम्नतम ऊर्जा होती है। | |||
== प्रमुख बिंदु == | == प्रमुख बिंदु == | ||
Latest revision as of 09:10, 24 June 2024
Bohr's radius
बोर त्रिज्या, जिसे a0 के रूप में दर्शाया गया है, परमाणु भौतिकी में एक मौलिक स्थिरांक है। यह हाइड्रोजन परमाणु या हाइड्रोजन जैसे आयन के निम्नतम ऊर्जा स्तर (जमीनी अवस्था) में नाभिक और इलेक्ट्रॉन के बीच की औसत दूरी को दर्शाता है। नील्स बोर के परमाणु मॉडल में बोर त्रिज्या एक प्रमुख अवधारणा है।
गणितीय समीकरण
बोर त्रिज्या (a0) को समीकरण द्वारा परिभाषित किया गया है:
जहाँ:
बोर त्रिज्या है।
निर्वात पारगम्यता (एक मौलिक स्थिरांक, लगभग) है।
ℏ घटा हुआ प्लैंक स्थिरांक () है।
इलेक्ट्रॉन का द्रव्यमान ( ) है।
प्राथमिक आवेश () है।
भौतिक व्याख्या
बोर त्रिज्या हाइड्रोजन परमाणु की जमीनी अवस्था में इलेक्ट्रॉन की कक्षा के "आकार" का प्रतिनिधित्व करती है। दूसरे शब्दों में, यह हमें इलेक्ट्रॉन और नाभिक के बीच की औसत दूरी का अंदाजा देता है जब इलेक्ट्रॉन अपने निम्नतम ऊर्जा स्तर पर होता है।
आरेख
यहां हाइड्रोजन परमाणु में बोर त्रिज्या की अवधारणा को दर्शाने वाला एक सरलीकृत चित्र दिया गया है:
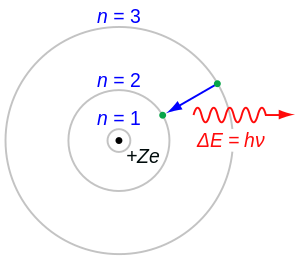
आरेख में, नाभिक (प्रोटॉन) केंद्र में है, और इलेक्ट्रॉन बोर त्रिज्या () की औसत दूरी पर नाभिक की परिक्रमा करता है। इलेक्ट्रॉन की गति को विशिष्ट ऊर्जा स्तरों में परिमाणित किया जाता है, जिसमें आधार अवस्था में निम्नतम ऊर्जा होती है।
प्रमुख बिंदु
- बोर त्रिज्या एक मौलिक स्थिरांक है जिसका उपयोग हाइड्रोजन परमाणु की जमीनी अवस्था में इलेक्ट्रॉन की कक्षा के आकार का वर्णन करने के लिए किया जाता है।
- यह इलेक्ट्रॉन के द्रव्यमान, प्राथमिक आवेश और प्लैंक स्थिरांक जैसे मूलभूत स्थिरांकों से प्राप्त होता है।
- बोर मॉडल परमाणु संरचना का एक सरल लेकिन मूल्यवान विवरण प्रदान करता है।
संक्षेप में
बोर त्रिज्या एक मौलिक स्थिरांक है जो हाइड्रोजन परमाणु की जमीनी अवस्था में नाभिक और इलेक्ट्रॉन के बीच की औसत दूरी को दर्शाता है, जैसा कि नील्स बोर के परमाणु मॉडल द्वारा वर्णित है।