बोर त्रिज्या
Listen
Bohr's radius
बोर त्रिज्या, जिसे a0 के रूप में दर्शाया गया है, परमाणु भौतिकी में एक मौलिक स्थिरांक है। यह हाइड्रोजन परमाणु या हाइड्रोजन जैसे आयन के निम्नतम ऊर्जा स्तर (जमीनी अवस्था) में नाभिक और इलेक्ट्रॉन के बीच की औसत दूरी को दर्शाता है। नील्स बोर के परमाणु मॉडल में बोर त्रिज्या एक प्रमुख अवधारणा है।
गणितीय समीकरण
बोर त्रिज्या (a0) को समीकरण द्वारा परिभाषित किया गया है:
जहाँ:
बोर त्रिज्या है।
निर्वात पारगम्यता (एक मौलिक स्थिरांक, लगभग) है।
ℏ घटा हुआ प्लैंक स्थिरांक () है।
इलेक्ट्रॉन का द्रव्यमान ( ) है।
प्राथमिक आवेश () है।
भौतिक व्याख्या
बोर त्रिज्या हाइड्रोजन परमाणु की जमीनी अवस्था में इलेक्ट्रॉन की कक्षा के "आकार" का प्रतिनिधित्व करती है। दूसरे शब्दों में, यह हमें इलेक्ट्रॉन और नाभिक के बीच की औसत दूरी का अंदाजा देता है जब इलेक्ट्रॉन अपने निम्नतम ऊर्जा स्तर पर होता है।
आरेख
यहां हाइड्रोजन परमाणु में बोर त्रिज्या की अवधारणा को दर्शाने वाला एक सरलीकृत चित्र दिया गया है:
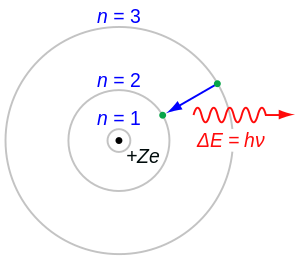
आरेख में, नाभिक (प्रोटॉन) केंद्र में है, और इलेक्ट्रॉन बोर त्रिज्या () की औसत दूरी पर नाभिक की परिक्रमा करता है। इलेक्ट्रॉन की गति को विशिष्ट ऊर्जा स्तरों में परिमाणित किया जाता है, जिसमें जमीनी अवस्था में सबसे कम ऊर्जा होती है।
प्रमुख बिंदु
- बोर त्रिज्या एक मौलिक स्थिरांक है जिसका उपयोग हाइड्रोजन परमाणु की जमीनी अवस्था में इलेक्ट्रॉन की कक्षा के आकार का वर्णन करने के लिए किया जाता है।
- यह इलेक्ट्रॉन के द्रव्यमान, प्राथमिक आवेश और प्लैंक स्थिरांक जैसे मूलभूत स्थिरांकों से प्राप्त होता है।
- बोर मॉडल परमाणु संरचना का एक सरल लेकिन मूल्यवान विवरण प्रदान करता है।
संक्षेप में
बोर त्रिज्या एक मौलिक स्थिरांक है जो हाइड्रोजन परमाणु की जमीनी अवस्था में नाभिक और इलेक्ट्रॉन के बीच की औसत दूरी को दर्शाता है, जैसा कि नील्स बोर के परमाणु मॉडल द्वारा वर्णित है।